La farmacovigilancia veterinaria, una herramienta esencial para el mejor uso de los medicamentos

La Farmacovigilancia Veterinaria (FV) es la ciencia y actividades vinculadas a la detección, la evaluación, la comprensión y la prevención de las sospechas de acontecimientos adversos (AA) o cualquier otro problema relacionado con un medicamento (Reglamento (UE) 2019/6 del Parlamento Europeo y del Consejo de 11 de diciembre de 2018, sobre medicamentos veterinarios).
Es probable que muchos veterinarios clínicos no estén familiarizados con este término que, sin embargo, lleva utilizándose desde hace ya muchos años tanto en la UE como en España.
Todos los medicamentos, ya sean de medicina humana o de veterinaria, nos ayudan a mejorar nuestro estado de salud y el de los animales, y a prevenir ciertas enfermedades propias o zoonóticas, contra las que es muy importante luchar en el entorno de “One Health”. A medida que la ciencia ha ido progresando, los recursos tecnológicos y el desarrollo científico han permitido que los medicamentos sean cada vez de mayor calidad y, por tanto, más seguros y eficaces. La farmacovigilancia nos ayuda a que el balance beneficio/riesgo que se ha demostrado en el momento de la autorización de comercialización un fármaco siga siendo positivo, a pesar de los riesgos inherentes que entraña la administración de cualquier medicamento. En el momento en que dicho balance se vuelve negativo, se toman las medidas correctoras oportunas para gestionar y minimizar los riesgos, entre las que está, como ejemplo, la suspensión de la autorización de comercialización o la retirada de lotes del mercado.
En los estudios clínicos realizados en la etapa pre-autorización de los medicamentos, se realizan pruebas con un número de animales necesariamente limitado (por razones éticas y económicas) y solo se prueba ese medicamento en la especie/s animales para las que se quiere autorizar. Cuando el medicamento se autoriza, comienza a aplicarse a un mayor número de animales, esto es, población diana del medicamento, en diversos países, en diferentes razas, en distintos estadios fisiológicos y edades, con condiciones de alimentación y manejo muy variables y, con frecuencia, administrado junto con otros medicamentos, e incluso, en base a la prescripción excepcional, en especies animales para las que el medicamento no está autorizado.
Este uso post autorización de los medicamentos nos permite ver los AA que pueden ocurrir en los animales cuando los medicamentos se aplican en condiciones más amplias que en los estudios pre-autorización, y ahí comienza nuestra labor de vigilancia, pues pueden aparecer nuevos problemas de eficacia o de seguridad, o problemas conocidos en el momento del registro del medicamento pero que se presentan con más frecuencia o gravedad que los conocidos hasta la fecha.
Por tanto, la FV se ocupa de la evaluación de la seguridad y la eficacia de los medicamentos veterinarios, una vez que el medicamento se comercializa tras la correspondiente autorización, en las condiciones reales de uso.
La misión de la FV es asegurar: el uso seguro de los medicamentos veterinarios en los animales; la seguridad para el consumidor de los alimentos de origen animal; la seguridad de las personas que estén en contacto con los medicamentos veterinarios; la seguridad en el medio ambiente de los medicamentos veterinarios; la seguridad de los medicamentos de uso humano administrados a los animales; o la eficacia de los medicamentos veterinarios en los animales.
Veterinarios que notifican, veterinarios responsables
Los veterinarios clínicos, tanto de animales de compañía como los de animales de producción y exóticos, están en una posición idónea para detectar los posibles AA cuando ocurren, y su comunicación contribuye directamente a conocer en mayor profundidad la seguridad y eficacia de estos medicamentos y, en su caso, poder tomar medidas correctoras lo más precozmente posible.
Estas observaciones son la base sobre la que la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) puede aportar información adecuada y actualizada durante todo el ciclo de vida de estos productos, tras la evaluación de los datos recibidos.
Es muy importante que todas las sospechas de AA se comuniquen a la autoridad competente (la AEMPS), independientemente de su gravedad, de si están o no descritas en el resumen de características del medicamento o prospecto, etc., no solo porque esté así legalmente establecido en el Real Decreto 1157/2021, sino porque es la única forma de tener conocimiento de lo que está ocurriendo realmente en la clínica diaria y, a partir de ahí poder hacer una evaluación completa y continua de los beneficios y riesgos de cada medicamento en condiciones reales de uso.
¿Qué y cómo se deben comunicar los acontecimientos adversos?
Desde la entrada en vigor de la nueva reglamentación en materia de medicamentos veterinarios (Reglamento 2019/6 (UE) y Real Decreto 1157/2021), los veterinarios tienen la obligación de “notificar cualquier sospecha de AA de la que tengan conocimiento y enviarla lo más rápidamente posible, en un plazo máximo de 15 días, a la AEMPS o al titular de autorización del producto”.
Hablamos de AA cuando nos referimos a: reacción adversa (entendida como un efecto nocivo en el animal) con muerte del animal; reacción adversa que causa signos significativos, prolongados o permanentes; reacción adversa inesperada, es decir; que no figura en el prospecto o en el etiquetado; reacción adversa en personas; reacción adversa aparecida en un uso fuera de autorización (pe. en otra especie animal o para una indicación no autorizada del medicamento); falta de la eficacia esperada (que pudiera indicar la aparición de resistencias o la ineficacia de ciertas vacunas, como ejemplos de ello); problema relacionado con los tiempos de espera (posibilidad de residuos de medicamentos en alimentos de origen animal-carne, leche, huevos-); posibles problemas medioambientales; o reacción adversa a medicamentos de uso humano administrados en animales.
Ejemplos prácticos de AA los tenemos en: una reacción anafiláctica tras la administración de una vacuna en cualquier animal; un caso de vómitos y/o síntomas neurológicos tras la colocación de un collar antiparasitario a un animal de compañía; una detección de residuos de antibióticos en leche, detectada en una empresa; una muerte ocurrida en un animal silvestre o doméstico como consecuencia de la exposición a un medicamento (o a una res tratada con un medicamento); la existencia de sintomatología en el dueño de un animal o en el veterinario a consecuencia del contacto directo con el medicamento durante o tras la administración del mismo; la detección de una supuesta falta de eficacia tras vacunar a un animal y diagnosticarse posteriormente la enfermedad que se pretendía evitar; o un caso de sintomatología digestiva/nerviosa/general tras la administración de un medicamento a un animal que no es especie de destino (en casos de prescripción excepcional por vacío terapéutico).
Es importante destacar que en este último caso, es decir, cuando se administra un medicamento fuera de las condiciones establecidas en la Ficha Técnica, no se juzga por parte de la AEMPS cómo se ha utilizado dicho medicamento en la clínica, únicamente interesa conocer los AA tras ese uso, con el fin de poder advertir de ello en un futuro, y en el caso de ser necesario, para que otros veterinarios puedan conocerlo en caso de decidir utilizarlo de la misma forma por necesidad, por bibliografía, por conocimiento propio o por cualquier otra razón.
Además de lo indicado, si el AA es grave, especialmente si hay muerte del animal o una persona se ve afectada, el caso debe comunicarse inmediatamente.
En la AEMPS, hay dos formas esenciales para realizar la notificación de estos AA:
1) A través del formulario europeo de uso exclusivo por veterinarios, conocido en España como TARJETA VERDE, que se puede encontrar en la página web de la AEMPS (www.aemps.gob.es); esta tarjeta puede descargarse (http://bit.ly/tarjeta_verde) y se rellenarse on line o a mano, y se manda al correo del Área de Farmacovigilancia eterinaria (fv_vet@aemps.es).

2) A través de NotificaVet, formulario electrónico disponible igualmente en la página web de la AEMPS (https://sinaem.aemps.es/fvvet/NotificaVet),, que redirige los casos directamente a la base de datos del Área de Farmacovigilancia Veterinaria de la AEMPS. Este método es cómodo e intuitivo, de manera que van rellenándose los campos (con o sin desplegables) y finalmente se envía, obteniéndose un código para que el notificador veterinario pueda buscar de nuevo el caso, con objeto de incluir nuevos datos (informes, radiografías, diagnósticos, fallos detectados).

En ambos casos, queremos resaltar la importancia de cumplimentar el formulario lo más completo posible, pues todos los campos son de interés para una correcta evaluación del caso, comenzando por los datos obligatorios: notificador, animal/persona que sufre el AA, medicamento/s administrado/s, síntomas observados y fechas de aparición, así como aportar (si se dispone de ellos) los análisis laboratoriales, informes post-mortem, fotografías y otros datos relevantes que pudieran estar a disposición de la persona que notifique el AA.
La AEMPS procederá a validar y evaluar todas y cada una de las notificaciones enviadas por los veterinarios, solicitaremos información adicional (si fuese necesario) poniéndonos en contacto con los notificadores. Por ello, es importante indicar los datos de contacto (tfno./email), que en ningún caso se difundirán, existiendo una perfecta anonimización de estos datos tanto del notificador primario, como del paciente y del dueño de los animales.
Además de estos dos sistemas, existen otros dos sistemas de notificación en España que son uno, a través de RECEVET, plataforma de receta electrónica veterinaria del Consejo Andaluz de Colegios Oficiales de Veterinarios, y otro, PRESCRIVET, sistema electrónico del Consejo General de Colegios Oficiales de Veterinarios de España que permite a los veterinarios hacer recetas y además, notificar acontecimientos adversos.
¿Qué ocurre tras comunicar una sospecha de acontecimiento adverso?
Todos los casos recibidos en la AEMPS o recibidos por los titulares de autorización, una vez validados y evaluados, se envían a la base de datos de FV de la UE (EVVET o Union Pharmacovigilance Data Base), que recopila todos los casos recibidos a nivel mundial, enviados exactamente de la misma manera que en España, esto es, por los veterinarios de todos los países en donde se comercializan/aplican los medicamentos.
El objetivo de todo esto es realizar un análisis conjunto de todos los casos recibidos de cada medicamento a través de un proceso de Detección de Señales a nivel mundial (Reglamento 2019/6) que determine si el balance beneficio/riesgo del medicamento sigue siendo positivo o, si por el contrario, es negativo y corresponde tomar alguna medida, entre las que están: inclusión de advertencias en el resumen de características y en el prospecto; cambios en las condiciones de uso autorizadas; modificación del tiempo de espera; retirada de lotes del mercado; o suspensión de la autorización de comercialización del medicamento.
Un buen sistema de FV ayuda a la detección de nuevos AA y a comprender mejor los ya conocidos o a ajustar las frecuencias de su presentación.
La comunicación de los AA ayuda a controlar de manera continuada los beneficios y los riesgos de los medicamentos veterinarios una vez que se comercializan, contribuyendo a su uso seguro.
Por ello, participar en el sistema de FV contribuye a un mejor conocimiento de los medicamentos veterinarios, con beneficios para los animales, las personas, el medioambiente y los profesionales de la sanidad veterinaria.
Datos de acontecimientos adversos en España en 2024
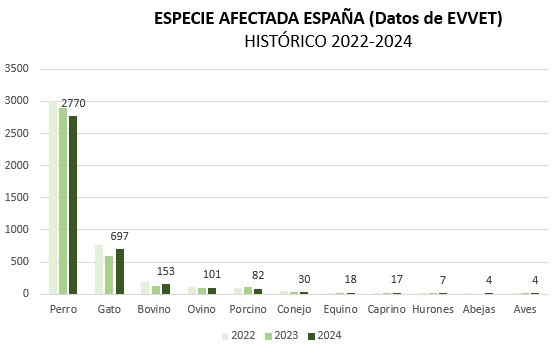
En España recibimos el pasado año un total de aprox. 3820 notificaciones. Los datos del 2024 ofrecen una mayoría de AA notificados en animales de compañía (fundamentalmente perros) lo cual es una buena noticia, ya que observamos que los veterinarios clínicos de animales de compañía tienen un buen nivel de notificación de casos.
En el caso de animales productores de alimentos, somos conscientes de las dificultades añadidas en el marco del trabajo rural, y que no es igual de fácil disponer de los medios y del tiempo para realizarlo.
No obstante, intentamos mejorar estas cifras año a año, pues sabemos que sigue habiendo AA que no se notifican y es información que pierde el sistema. En este sentido, llevamos muchos años haciendo campañas de promoción de la notificación de las AA, por ejemplo, a través de charlas desde las Facultades, en las CCAA, en congresos de profesionales veterinarios (AVEPA, Iberzoo Propet) y publicación de artículos en revistas especializadas, para que los veterinarios sean conscientes de la importancia de notificar y de sus obligaciones al respecto.
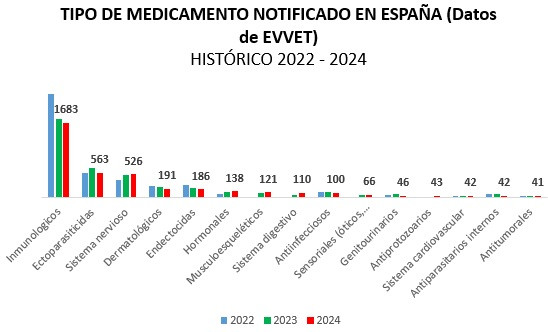
En cuanto a los medicamentos con mayor número de notificaciones el pasado año, observamos que las vacunas encabezan la primera posición en España, seguidos de los ectoparasiticidas (collares, spot-on, etc.). Son los medicamentos con mayor número de AA y posiblemente las más graves.
De cualquier manera, se intenta concienciar de la importancia de notificar cualquier tipo de AA, independientemente de la gravedad del caso.
Por último, solo destacar que en la AEMPS recibimos muchas consultas sobre diversos temas relativos a los AA y que se contesta cualquier tipo de duda relativa tanto de los veterinarios, como de los titulares, así como del público en general. Recordamos nuevamente nuestro buzón: fv_vet@aemps.es .
Somos conscientes de que la notificación requiere un cierto esfuerzo por parte de todos los agentes implicados, pero merece la pena, puesto que el mayor conocimiento de nuestros medicamentos siempre redundará en un mejor uso de ellos, en información más completa del producto y al alcance de todos y, por tanto, en medicamentos más seguros y eficaces en el mercado, tanto para los animales y las personas, como para el medio ambiente.
Recomendados

Archivo












